下列说法正确的是
| A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同 |
| B.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| C.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 |
| D.元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
下列表示化学反应的离子方程式,其中正确的是
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| B.向氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O=AlO2- + 4NH4+ +2H2O |
| C.用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: 2 MnO4-+6H++ 5H2O2=2Mn2++5 O2 ↑+ 8H2O |
D.用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O H2↑+ Cl2↑ + 2OH- H2↑+ Cl2↑ + 2OH- |
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示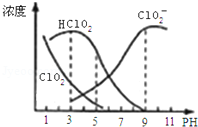
(Cl﹣没有画出).则下列分析正确的是
| A.亚氯酸钠在酸性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6 |
| C.pH越大,该漂白剂的漂白性能越好 |
| D.25℃,pH=3时,NaClO2溶液中:c(Na+)+(H+)=c(ClO2-)+c(OH-) |
常温下,下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入SO2气体的溶液中:Ca2+、I-、ClO-、NO3- |
| C.c(Fe3+)=" 0.1" mol•L-1的溶液中:Na+、I-、SCN-、SO42- |
| D.由水电离出的c(H+)=1.0×10-13mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
氨基钠和氢化钠与水反应的化学方程式如下:①NaNH2+H2O=NaOH+NH3↑
②NaH+H2O==NaOH+H2↑,下列叙述正确的是
| A.氨基钠和氢化钠与盐酸反应都只生成一种盐 |
| B.方程式②中,每生成1mol H2转移1 mol电子 |
| C.氨基钠和氢化钠的晶体中都只含离子键 |
| D.方程式①中,氨基钠是还原剂 |
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水。下列说法正确的是
| A.元素Y、Z、W的简单离子具有相同的电子层结构,其半径依次增大 |
| B.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
| C.元素X与元素Y能形成两种化学键类型完全相同的化合物 |
D.元素X、Z形成化合物的电子式可以表示成 |