A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 (用离子符号表示)。
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
(6)在101 kPa、25℃下,16 g 液态C2A4在D2中完全燃烧生成气体C2,放出312 kJ热量,则C2A4和D2反应的热化学方程式为 。
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移____________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是___________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下: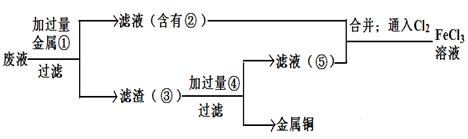
请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:
A.Ag2O+ H2O2=2Ag+O2 ↑+ H2O
B.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)写出一个H2O2既体现氧化性又体现还原性的化学反应方程式。
(2)将下列物质:H2O2、K2SO4、MnSO4、H2SO4、KMnO4、O2的化学式分别填在空白处组成一个不需配平的化学方程式:+ +______ →+ + + H2O
①该反应中的还原剂是。
②该反应中,发生还原反应的元素是。
(3)氧化性:KMnO4_____K2CrO4(填“>”或“<”)。
有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,进行下列实验:
(1)A+C→溶液①+气体①(2)B+A→溶液②+沉淀①
(3)C+B→溶液③+沉淀②(4)溶液③+沉淀①→溶液④+气体①
根据上述实验结果,写出上述过程的离子方程式:
(1)。
(2)。
(3)。
(4)。
已知:在水溶液或融熔状态下能导电的化合物叫电解质。现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤BaSO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中溶于水后形成的水溶液能导电的是。
(15分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上电子数是K层上电子数的3倍 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素X位于元素周期表的位置 ,它的一种核素可测定文物年代,这种核素的符号是 。
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出溶液中检验该微粒方法的离子反应方程式 。
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是 ,理由是 。