根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.075 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6,-2 |
-2 |
A.氢化物的沸点为H2T<H2R,金属性L>Q
B.M与T 形成的化合物具有两性
C.L2+与R2-的核外电子数相等
D.L的原子半径最大,电负性最小,T的原子半径最小,电负性最大
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
| A.9.0 | B.9.5 | C.10.5 | D.11.5 |
下列操作中能使电离平衡H2O H++OH-,向右移动且溶液呈酸性的是()
H++OH-,向右移动且溶液呈酸性的是()
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
在一密闭容器中进行反应 X2(g)+ 3Y2(g)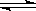 2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,当反应达到平衡后,各物质的浓度有可能是()
2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,当反应达到平衡后,各物质的浓度有可能是()
| A.c(X2)=0.2 mol/L | B.c(Y2)=0.1 mol/L |
| C.c(Z2)=0.4 mol/L | D.c(Y2)=0.6 mol/L |
对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g) 其它条件不变,减小压强时,对反应产生的影响是( )
2Z(g) 其它条件不变,减小压强时,对反应产生的影响是( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向正反应方向移动 |
| D.正、逆反应速率都减小,平衡向逆反应方向移动 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中化学反应速率最快的是( )
2AB3(g)反应来说,以下化学反应速率的表示中化学反应速率最快的是( )
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |