我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
(1)一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
(2)为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程: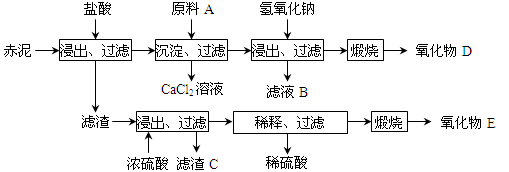
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式_________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式__________________________。
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示: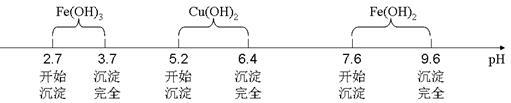
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)
① ② ③ ④ ⑤
(2)溶液A中所含溶质为 ;
(3)物质X应选用 (填序号),沉淀II的主要成分是
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为 。
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 |
第一次 |
第二次 |
第三次 |
| 滴定前读数(mL) |
0.10 |
0.36 |
1.10 |
| 滴定滴定后读数(mL) |
20.12 |
20.34 |
22.12 |
①CuSO4溶液与KI的反应的离子方程式为 。
②滴定中,试液Na2S2O3应放在 (填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
③溶液A中c(Cu2+)= mol·L-1
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧;烧碱和纯碱溶液均显碱性。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:__________________________(请你写出)。
【设计实验方案、验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是________________。
(2)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是______。
(3)钠在二氧化碳中燃烧的化学方程式为____________________。
(4)乙同学认为白色物质有可能是氢氧化钠.你是否同意乙同学的观点,并简述理由:_______。
实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。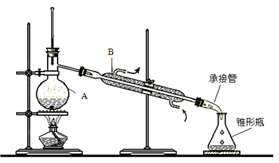
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是 。
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
实验室里需要纯净的溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: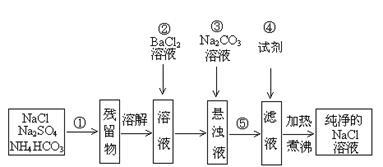
根据以上设计方案,回答下列问题:
(1)操作①和⑤的方法分别是 、 ;
(2)操作②是否可改为加硝酸钡溶液?为什么? ,(填是或否)理由: 。
(3)操作②后,如何判断SO42-已除尽,方法是 。
(4)操作③的目的是 ;
(5)操作④加的试剂是 ;发生反应的离子方程式为: 。
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取溶液体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中,需要使用的仪器除了烧杯,玻璃棒,还包括 。
③在配制过程中下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是 。
A.用量筒量取浓盐酸后用蒸馏水洗涤量筒,并把洗涤液转移入容量瓶中
B.配制过程动作过慢,浓盐酸中HCl挥发
C.溶液注入容量瓶前没有恢复到室温就进行定容
D.定容时俯视刻度线
E.定容时仰视刻度线
F.定容时不小心加水超过刻度线,立即用胶头滴管吸出使凹液面最低点与刻度线相切