固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。
(1)工业上正在研究利用CO2来生产甲醇燃料的方法。
已知:H2(g)+1/2O2(g)===H2O(g)ΔH1=-242 kJ/mol
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
①写出CO2和H2反应生成气态甲醇等产物的热化学方程式:___________________。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是________(填字母序号)。
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为________(填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的酸性与工作前相比将________(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为________。
已知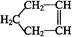 可简写为
可简写为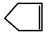 。降冰片烯的分子结构可表示为:
。降冰片烯的分子结构可表示为: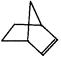
(1)降冰片烯属于__________。
A环烃 B不饱和烃 C烷烃 D芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4)降冰片烯不具有的性质__________。
A能溶于水 B能发生氧化反应
C能发生加成反应 D常温常压下为气体
写出下列反应的化学反应方程式,并判断其反应类型。
①乙醇的催化氧化:,属于反应;
②由苯制取溴苯:,属于反应;
③由苯制取环己烷:,属于反应;
④由乙烯制取聚乙烯:,属于反应;
有下列各组物质: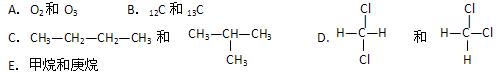
(1)_________组两物质互为同位素;(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。
(1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率,充分反应后产生氢气的量(相同、醋酸的多、盐酸的多),原因是。
(2) 在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入晶体,理由是;要使产生氢气的量不变,但反应速率减慢,可加入晶体,理由是。
在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入晶体,理由是;要使产生氢气的量不变,但反应速率减慢,可加入晶体,理由是。
可供选择的晶体有:
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 E.KHSO4 |
浓度为0.1mol/L的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________。