下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是 ,最活泼的金属元素是 ,最活泼的非金属元素是 。
(2)表中能形成两性氧化物的元素是 ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)③⑥⑦三种元素原子半径由大到小的顺序是 。
(4)用电子式表示由元素⑨⑦形成化合物的过程: 。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
| |
|
烧结法制氧化铝生产过程如下: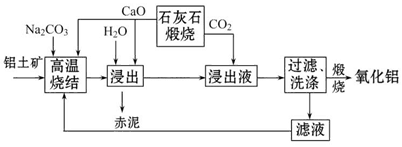
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
有100 mL NaOH溶液,先向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4 mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: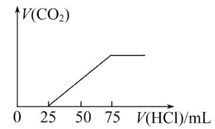
(1)NaOH在吸收CO2气体后,所得溶液中存在的溶质是:________,其物质的量是________。
(2)在加入盐酸情况下产生的CO2气体体积为(标准状况)________。
(3)原NaOH溶液的物质的量浓度是______________________________________;
若以Na2O2固体溶于水配得100 mL该溶液需Na2O2__________________________g。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收。
(3)As2S3和HNO3有如下反应: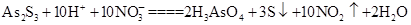 ,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量______(选填编号)。
a.小于0.5 mol
b.等于0.5 mol
c.大于0.5 mol
d.无法确定
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。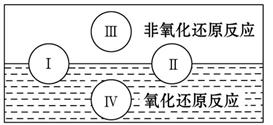
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________________,
其中水为_______剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
_____CuO+_____NH4Cl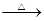 _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是_______(填元素名称),氧化剂是_______(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。每生成1 mol P4时,就有_______mol电子发生转移。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、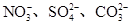 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是_________________________________________________;
所含的阴离子相同的两种盐的化学式是_____________________________________________。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示)________________。
(3)A和C的溶液反应的离子方程式是______________________________________________。
E和氨水反应的离子方程式是______________________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是__________________________________。