下列各组中的两物质相互反应时,与反应条件和用量无关的是
| A.Na和O2 | B.Fe和FeCl3 |
| C.CO2和NaOH | D.AlCl3和NaOH |
下列有关化学物质的俗称错误的是( )
| A.碳酸钠的俗称是纯碱 | B.四氧化三铁的俗称是磁性氧化铁 |
| C.氧化铁的俗称是铁红 | D.碳酸氢钠的俗称是苏打 |
能实现下列物质间直接转化的元素是( ) 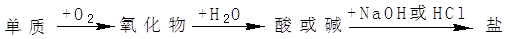
| A.硅 | B.硫 | C.铝 | D.铁 |
在指定条件下能够大量共存的一组离子是( )
| A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3- |
| B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3- |
| C.无色溶液: Cu2+、K+、SO42-、Cl- |
| D.强碱性溶液:K+、Mg2+、NO3-、HCO3- |
同温同压下,等体积的NH3和H2S气体相比较,下列叙述中正确的是( )
| A.质量之比为1∶1 | B.分子数之比为1∶2 |
| C.原子数之比为 4∶3 | D.密度之比为 2∶1 |
新制氯水与久置的氯水相比较,下列结论正确的是( )
| A.颜色相同 | B.都能使有色布条褪色 |
| C.都含有HClO | D.加AgNO3溶液都能生成白色沉淀 |