向20 mL AlCl3溶液中滴入2 mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义是 。
(2)图中B点表示的意义是 。
(3)若溶液中有Al(OH)3沉淀0.39 g,则用去NaOH溶液的
体积可能为 或 毫升。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: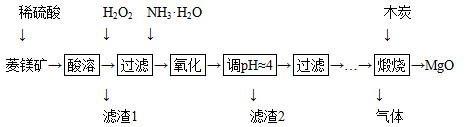
(1)MgCO3与稀硫酸反应的离子方程式为_______________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为______________________________。
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。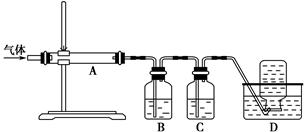
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下: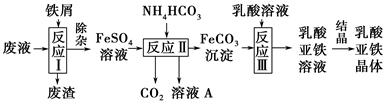
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_________________________________________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: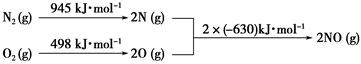
①写出该反应的热化学方程式:_______________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是____。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_____________________________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下: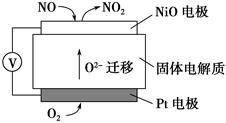
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:_______________________________________。
用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下: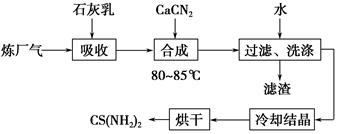
(1)高温下,H2S存在下列反应:2H2S(g)2H2(g)+S2(g),其平衡常数表达式为K=________________。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是_____________________________________________________;
过滤得到的滤渣可再利用,滤渣的主要成分是________(填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80~85 ℃)下进行,其目的是_______________________________________。
Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为________________________________。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为________________。