已知化学式为C12H12的物质其结构简式为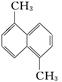 ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有
| A.4种 | B.9种 | C.12种 | D.6种 |
如图所示,烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为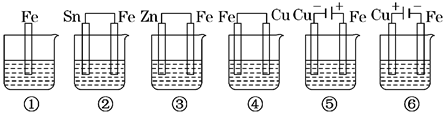
| A.②①③④⑤⑥ | B.⑤④③①②⑥ |
| C.⑤④②①③⑥ | D.⑤③②④①⑥ |
25 ℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为
| A.1010∶1 | B.5×109∶1 | C.108∶1 | D.1∶1 |
有A,B,C,D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A,D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显变化,若将铜浸入C的盐溶液中,有金属C析出。据此判断这四种金属的活动性由强到弱的顺序是
| A.D>C>A>B | B.D>A>B>C | C.D>B>A>C | D.B>A>D>C |
下列事实不能证明HNO2是弱电解质的是
①c(H+)=0.1mol•L﹣1的HNO2溶液稀释至1000倍,pH<4
②用HNO2溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
④0.1mol•L﹣1HNO2溶液的pH=2
⑤HNO2与CaCO3反应放出CO2气体.
| A.①⑤ | B.②⑤ | C.③⑤ | D.③④ |
25 ℃ 时,水的电离达到平衡:H2O  H+ + OH- ΔH > 0,下列叙述正确的是
H+ + OH- ΔH > 0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体NaOH,平衡逆向移动,c(H+)降低,KW减小 |
| D.将水加热,KW增大,pH不变 |