一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是 ①X的分解速率与X的生成速率相等
①X的分解速率与X的生成速率相等
②反应容器中压强不再变化 ③X、Y、Z的浓度不再变化
③X、Y、Z的浓度不再变化
④单位时间内生成l molY的同时生成l mol Z
| A.①③ | B.②③ | C.①② | D.②④ |
下列表述正确的是()
A.中子数为10的氧原子: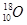 |
B.Na2S的电子式: |
| C.聚氯乙烯的结构简式:CH2CHCl |
| D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O |
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是 ( )
| A.碳酸钡和硫酸钡均可用于钡餐透视 |
| B.为防止食物变质,可加入适量的食品添加剂 |
| C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D.海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
生产、生活离不开化学。下列说法不正确的是( )
| A.不需要通过化学反应就能从海水中获得食盐和淡水 |
| B.燃料电池的燃料都在负极发生反应 |
| C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D.工业上常用高纯硅制造光导纤维 |
2013年1月我国大部分地区被雾霾笼罩,1月12日北京PM2.5指数濒临“爆表”,空气质量持续六级严重污染。PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6 m)的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )
| A.大雾的形成与汽车的尾气排放有一定的关系 |
| B.微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
| C.实施绿化工程,可以有效地防治PM2.5污染 |
| D.PM2.5表面积大,能吸附大量的有毒、有害物质 |
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
| A.在有机化工中,氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料 |
| B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |