NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.常温下,1 L 0.1 mol·L-1 NH4NO3溶液中的氮原子数为0.2NA |
| B.含有58.5 g氯化钠的溶液中含有NA个氯化钠分子 |
| C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| D.常温常压下,22.4 L乙烯中C—H的个数为4NA |
下列物质中,物质的水溶液能导且该物质属于非电解质,溶于水时化学键被破坏的是( )
| A.氯化氢 | B.蔗糖 | C.干冰 | D.硫酸钡 |
下列有关同分异构体数目的叙述中,错误的是
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B.含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
C.与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
D.菲的结构简式为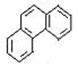 ,可有5种一硝基取代物 ,可有5种一硝基取代物 |
金银花中能提取出有很高药用价值的绿原酸(如下图),下列判断正确的是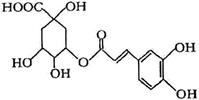
| A.分子中有可能所有碳原子共平面 | B.分子式为C16H18O9 |
| C.分子中含有醚键 | D.分子中有4个手性碳原子 |
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
| A.甲苯的硝化反应生成三硝基甲苯 | B.甲苯能使酸性高锰酸钾溶液褪色 |
| C.甲苯燃烧产生带浓烟的火焰 | D.1 mol甲苯与3 molH2发生加成反应 |
实验室可提供下列实验操作:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。如要鉴定1-氯丙烷中的氯元素,从中选择合适的操作步骤是
| A.③⑤⑦① | B.②③⑦① | C.②⑤⑦① | D.④②⑥① |