有下列两组命题
| A组 |
B组 |
| Ⅰ.H2O分子间存在氢键,H2S则无 |
①H2O比H2S稳定 |
| Ⅱ.晶格能NaI比NaCl小 |
②NaCl比NaI熔点高 |
| Ⅲ.晶体类型不同 |
③N2分子比磷的单质稳定 |
| Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大 |
④同周期元素第一电离能大的,电负性不一定大 |
B组中命题正确,且能用A组命题加以正确解释的是
A.Ⅰ① B.Ⅱ② C.Ⅲ③ D.Ⅳ④
乙醇在一定条件下发生化学反应时化学键断裂如图所示。则乙醇在催化氧化时,化学键断裂的位置是()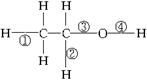
| A.②③ | B.②④ | C.①③ | D.③④ |
m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A.(3m+n)mol | B.( m+ m+ -3p)mol -3p)mol |
| C.(3m+n+2p)mol | D.(  m+ m+ )mol )mol |
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是()
| A.一定有甲烷 | B.一定有乙烯 | C.一定没有甲烷 | D.一定没有乙烯 |
1997年,英国的“克隆羊”备受世界关注。“克隆羊”的关键技术是找到一些特殊的酶,这些酶能激活普通细胞,使之像生殖细胞一样发育成个体。有关酶的叙述错误的是:( )
| A.酶是一种具有催化作用的蛋白质 |
| B.酶的催化作用具有选择性和专一性 |
| C.高温或重金属盐能降低酶的活性 |
| D.酶只有在强酸性或强碱性条件下才能发挥作用 |
苯环结构中,不存在单双键交替结构,可以作为证据的事实是()
①苯不能使KMnO4(H+)溶液褪色。
②苯分子中碳原子之间的距离均相等。
③苯能在一定条件下跟H2加成生成环己烷。
④经实验测得邻二甲苯仅一种结构。
⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因发生化学变化而使溴水褪色。
| A.②③④⑤ | B.①③④⑤ | C.①②④⑤ | D.①②③④ |