X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是
| A.五种元素中,原子半径最大的是W |
| B.Y的简单阴离子比W的简单阴离子还原性强 |
| C.Y与Z形成的化合物都可以和盐酸反应 |
| D.Z与Q形成的化合物水溶液一定显酸性 |
已知热化学方程式:
H2O(g) = H2(g) +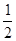 O2(g)△H =" +241.8" kJ·mol-1
O2(g)△H =" +241.8" kJ·mol-1
H2(g)+ 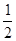 O2(g) = H2O(1)△H = -285.8 kJ·mol-1
O2(g) = H2O(1)△H = -285.8 kJ·mol-1
当18g液态水变为水蒸气时,其热量变化是
| A.吸热44 k J | B.吸热88kJ | C.放热44kJ | D.吸热2.44 kJ |
对于反应A(g)+2B(g)  2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
分别向1 L 0.5 mol·L-1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是
| A.ΔH1>ΔH2>ΔH3 |
| B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1>ΔH2=ΔH3 |
| D.ΔH1=ΔH2<ΔH3 |
密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
| A.70% | B.60% | C.50% | D.40% |
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1 |
| C.1/2 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1 |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1 |