往100 mL氢离子浓度为1mol·L-1的硫酸和硝酸混合液中投入3.84 g铜粉,微热使反应充分完成后,生成NO气体448 mL(标准状况)。则反应前的混合液中含硫酸的物质的量为
| A.0.01mol | B.0.02 mol | C.0.03 mol | D.0.04 mol |
在蒸发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可得到该物质固体的是
| A.氯化铝溶液 | B.硫酸亚铁溶液 | C.碳酸氢钠溶液 | D.硫酸铝溶液 |
关于如图所示装置的叙述,正确的是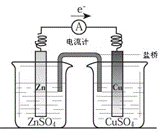
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
某同学为完成 2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验如图所示你认为可行的是
下列液体中所含粒子种类最多的是
| A.氨水 | B.硫化钠 | C.醋酸钠 | D.久置的氯水 |
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是:
| A.分离、提纯>确定化学式>确定实验式>确定结构式 |
| B.分离、提纯>确定实验式>确定化学式>确定结构式 |
| C.分离、提纯>确定结构式>确定实验式>确定化学式 |
| D.确定化学式>确定实验式>确定结构式>分离、提纯 |