关于硝酸的说法正确的是
| A.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水 |
| C.硝酸与金属反应时,主要是+5价的氮元素得电子 |
| D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
下列关于电解池的叙述中不正确的是()
| A.与电源正极相连的是电解池的阴极 |
| B.与电源负极相连的是电解池的阴极 |
| C.在电解池的阳极发生氧化反应 |
| D.电子从电源的负极沿导线流入电解池的阴极 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是()
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e=4OH- |
| D.Fe-3e=Fe3+ |
某反应过程中的能量变化如图所示,则该反应的△H为()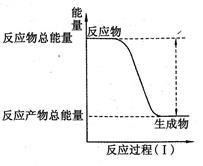
| A.△H>O | B.△AH<O |
| C.△H=O | D.无法判断 |
反应CO+H2O(g) CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是()
CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是()
| A.将压强减小至原来的一半 | B.添加催化剂 |
| C.将反应温度升高至1200 K | D.增大水蒸气的浓度 |
已知下列热化学方程式:
Zn(s)+1/2O2(g)═ZnO(s)△H=﹣351.1kJ•mol﹣1
Hg(l)+1/2O2(g)═HgO(s)△H=﹣90.7kJ•mol﹣1由此可知反应
Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为()
| A.﹣260.4 kJ•mol﹣1 | B.﹣441.8 kJ•mol﹣1 |
| C.+260.4 kJ•mol﹣1 | D.+441.8 kJ•mol﹣1 |