下列离子方程式正确的是
| A.乙酸与碳酸钠溶液反应:2H++CO32—="=" CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2 →CH3COO)2Cu+ 2 H2O |
| C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32— |
D.乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH—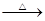 CH3COO-+NH4++2Ag↓+3NH3+H2O CH3COO-+NH4++2Ag↓+3NH3+H2O |
下列变化中,不需要破坏化学键的是
| A.三氧化硫溶于水 | B.次氯酸见光分解 | C.蔗糖溶于水 | D.氧气变成臭氧 |
位于同一周期的三种短周期元素X、Y、Z,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则三种元素的原子序数的大小顺序是
| A.X>Y>Z | B.Y>Z>X | C.X>Z>Y | D.Z>X>Y |
取代反应是有机化学中的一类重要的反应,下列过程中发生了取代反应的是
| A.乙烯通入溴的四氯化碳溶液发生的反应 |
| B.乙烷和氯气在光照条件下发生的反应 |
| C.在溴水中加入适量的苯,充分振荡后溴水层褪色 |
| D.乙炔在一定条件下与氯化氢发生的反应 |
从南方往北方长途运输水果时,常常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
| A.利用酸性高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 |
| B.利用酸性高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 |
| C.利用酸性高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 |
| D.利用酸性高锰酸钾溶液的氧化性,催熟水果 |
下列化学用语正确的是
A.氮分子的电子式: |
B.CH4分子的球棍模型: |
C.溴化钠的电子式: |
| D.次氯酸的结构式:H—O—Cl |