A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素。下列说法不正确的是
| B |
C |
| |
D |
A.简单离子的半径大小关系:B>C>E
B.D、E两种元素形成的化合物,可能含有离子键和共价键
C.A、B、C三种元素形成的化合物,晶体类型一定相同
D.B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
升高温度,下列数据不一定同时增大的是
| A.化学反应速率v |
| B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K |
| D.水的离子积常数KW |
在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)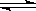 CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
B.v正( CO)=v逆(H2O) CO)=v逆(H2O) |
C.生成n mol CO的同时 生成n mol H2 生成n mol H2 |
| D.1 mol H—H键断裂的同时断裂2 mol H—O键 |
下列情况下,反应速率相同的是
| A.等体积0.1 mol·L-1HCl和0.1 mol·L-1 CH3COOH分别与等体积0.2 mol·L-1 NaOH溶液反应 |
B. 等质量锌粒和锌粉分别与等量1 mol·L-1 HCl反应 等质量锌粒和锌粉分别与等量1 mol·L-1 HCl反应 |
| C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应 |
D.等体积0.2 mol·L-1 HCl和0.1 mol·L-1 H 2SO4与相同的石灰石反应 2SO4与相同的石灰石反应 |
进行如下实验,在A锥形瓶中放入10g块状CaCO3,在B锥形瓶中放入5g粉末状CaCO3,分别加入50mL2mol/L盐酸。下图中能正确表示实验结果的是
反应4A(s)+3B(g)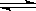 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、 C、D表示的反应速率其比值是3:2:1
C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐 渐减小的
渐减小的