已知:A(g)+B(g)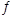 C(g)+D(g)
C(g)+D(g) 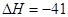 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下: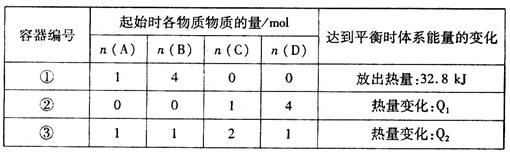
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L·min)
B.平衡时,①与②容器中A的体积分数相等
C.③达平衡时体系能量的变化主要为热能转化为化学能
D.容器③中,开始时v(B)生成>v(B)消耗
下列有关溶液物质的量浓度的说法正确的是
| A.把1 molNaCl溶于1 L水中所得溶液物质的量浓度为1mol/L |
| B.把0.1molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后浓度为1 mol/L |
| C.把7.4gCa(OH)2放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol/L |
| D.需要78 mL 0.1 mol/L的Na2CO3溶液,应选用l00 mL容量瓶 |
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质、K的性质的预测,其中正确的是
| A.K是银白色金属,硬度大,熔点高 |
| B.K可以被空气中的氧气所氧化,且产物只有K2O |
| C.K与水能够反应,但不如Na与水的反应剧烈,产物都有氢气 |
| D.K也可以与氯气反应,但比Na与氯气的反应剧烈 |
下面有关Na2CO3与NaHCO3的性质比较中错误的是
| A.相同浓度溶液的碱性:Na2CO3>NaHCO3 |
| B.同条件下在水中的溶解度:Na2CO3>NaHCO3 |
| C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D.热稳定性:NaHCO3<Na2CO3 |
已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6 :1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
2010年4月我国玉树发生地震灾害,假如你是卫生防疫人员,为配制0.01mol•L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
| A.称量时,左盘高,右盘低 | B.定容时俯视容量瓶刻度线 |
| C.原容量瓶洗净后未干燥 | D.摇匀后见液面下降,再加水至刻度线 |