【化学—选修2—化学与技术】(12分)Na2S2O3· 5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是______________。
(2)吸收塔中的原料B可以选用_____________(填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。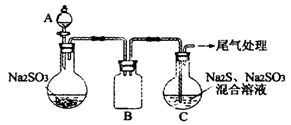
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是_____________。装置B的作用是______________。
②C中制备Na2S2O3发生的连续反应有:Na2S+H2O+SO2==Na2SO3+H2S_____________和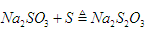 。
。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为______________。
一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)===XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g/L,则:
(1)反应前O2的体积是________________。
(2)化合物XY2的摩尔质量是________________。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和__________(写元素符号)。请写出 Y的离子结构示意图为。
(4)已知X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,则它们能够形成种XY2分子。
为了除去下列物质中含有的少量杂质(括号中)填写出所用试剂或方法。
⑴CO(CO2)试剂,操作方法的名称。
⑵Cu粉(Zn粉)试剂,操作方法的名称。
⑶自来水(Fe3+)操作方法的名称。
⑴实验室制取Cl2的化学方程式为。
⑵工业上电解饱和食盐水制取氯气,该反应的化学方程式为。在接电源(填“正”或“负”)极的电极上可以收集到Cl2。
有以下几种物质:①食盐晶体②乙醇③水银④蔗糖⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液⑦熔融的氢氧化钠⑧液态氯化氢填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;
(2)以上物质可以导电的是;
(3)以上物质中属于电解质的是;
(4)以上物质中属于非电解质的是。
同温同压下,若A容器中充满气体Ox和B容器中充满气体Oy
(1)若所含分子总数相等,则A容器和B容器的容积之比是(用x、y表示,下同)
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是
(3)若两容器的体积比为y∶x,则Ox和Oy物质的量之比为_________,质量之比为_______,密度之比为______________。