NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有 (任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式 。
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠 (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是 (选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是 (选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl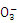 +6H+
+6H+ 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是 。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO 2和NO,并验证其性质,装置图如下:
2和NO,并验证其性质,装置图如下:
⑴写出甲中反应的离子方程式: ______________________;乙中的现象是____________,可证明NO2的氧化性;在丙中鼓入空气后现象是__________,可证明NO的还原性。
⑵实验前丙中充满水的作用是____________________________________________(用反应方程式和简要文字回 答)。
答)。
⑶小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是__________________________________。你认为怎样才能准确证明NO2的氧化性?______________________________________________________(简要回答出原理和现象即可)
某矿抽出的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组拟用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KO H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
请根据以上流程,回答相关问题:
⑴试剂a应该选用_______________;
⑵操作①、②、③、④、⑤的名称是_________(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 | B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 | D.萃取、分液、分液、过滤、蒸发结晶 |
⑶欲除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出b所代表的试剂,按滴加顺序依次是(填化学式)。
⑷调节pH 的作用是,操作方法是。
的作用是,操作方法是。
⑸操作⑤中用到的瓷质仪器名称是。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入 ,目的是 。
(2)反应中加入过量的乙醇,目的是 。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,配制乙醇、浓硫酸混合液的操作方法是 。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图如下:
则试剂a是: ,分离方法I是 ,分离方法II是 ,
试剂b是 ,分离方法III是 。
(5)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离 出来。甲、乙两人实验结果如下,并回答问题,
出来。甲、乙两人实验结果如下,并回答问题,
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为上述实验没有成功。
①甲实验失败的原因是: ②乙实验失败的原因是:
②乙实验失败的原因是:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L6.0mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请回答下列各题:
(1)写出①中发生铝热反应的化学方程式。
(2)写出③中所发生的各反应的离子方程式是。
(3)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为mol·L-1,c(Fe2+)
为mol·L-1。
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。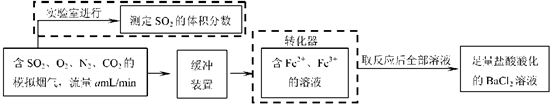
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)。(参考:还原性SO2> I- >Br->Cl-)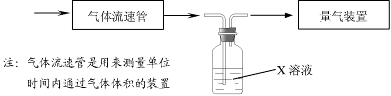
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是。
(4)为进一步减少SO2的 污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+
污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+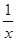 Sx 、
Sx 、
CO+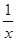 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+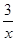 Sx 。其中COS中“C”化合价为。
Sx 。其中COS中“C”化合价为。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇【CH3OH】,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式。