以炼铅厂铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)为原料生产氯化锌的工艺流程如下:
(1)“酸浸”时一般控制温度为30 ℃,温度不宜过高的原因是 。
(2)“氧化”时需控制溶液的pH为5。写出KMnO4氧化Fe2+为Fe3+的离子方程式 。实际生产中高锰酸钾用量远多于理论用量的原因是 。
(3)物质A的化学式是 。
(4)写出流程中省略的操作步骤: ,若操作不当则会产生杂质Zn(OH)Cl,欲降低产品中该杂质的含量,可以采取的方法是 。
(11分)甲同学用如图所示的装置制取氯化铁,A是氯气发生装置(用浓盐酸和二氧化锰),B中的饱和食盐水用来除氯气中混有的氯化氢。D管中放置有铁粉。氯化铁在潮湿的空气中会和水剧烈反应冒出烟雾。试完成下列问题:
(1)烧瓶A中发生反应的化学方程式为:
(2)气体通过容器C的目的是:
(3)石英玻璃管D中发生反应的化学方程式是:
(4)球形干燥管E中碱石灰的作用是:
(5)氯化铁在潮湿的空气中和水剧烈反应冒出烟雾的化学方程式是
(6)乙同学认为甲同学装置中的B可以不用,将A与C直接相连就行了。
丙同学认为乙同学这样做,可能引起爆炸,而且生成的氯化铁中可能混有氯化亚铁。丙同学为了验证自已的猜想是正确的,取了乙同学制取的氯化铁固体少量加入试管中,并加入稀硝酸,观察到液面上面出现红棕色,而且红棕色渐渐上移,最后只在试管口可观察到红棕色,试管内气体无色,由此丙同学认为乙同学制取的氯化铁固体中含有氯化亚铁。
你认为丙同学所说的爆炸可能原因是;你认为丙同学用稀硝酸而不用酸性高锰酸钾溶液来检验氯化亚铁的存在的原因是
实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: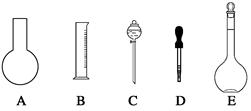
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液需用到的玻璃仪器除上述列出的仪器和玻璃棒外,还需要用到的玻璃仪器是(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用mL量筒最好。
某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。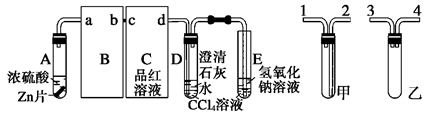
试回答:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:____________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是______________________________________________。
(3) ①能证明浓硫酸具有强氧化性的实验现象为____________________________________;
②反应较长时间后气泡量又会明显增加的原因是_______________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
某研究性学习小组在做Na2O2与水反应实验时,发现向Na2O2与水反应后的溶液中滴加酚酞试液,溶液呈现红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去.
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大.
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质.
(1)验证甲同学的推测是否正确的方法是__________________________,验证乙同学的推测是否正确的方法是__________________________________;
(2)有同学提出用定量的方法探究丙同学的推测中是否含有H2O2,其实验方法为:称取2.6 g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论.
①若在标准状况下测量气体的体积,应选用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”).
②若实际测得气体体积小于理论值,试用反应方程式表示Na2O2与水反应的实际过程:。
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理