乙炔(
)是生产聚氯乙烯的重要原料。用电石(主要成分为
)与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙92.5℅,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
(1)乙炔中碳、氢元素的质量比为
(2)100
上述电石渣中氢氧化钙的质量为
(3)用上述电石渣处理含硫酸196
的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
实验室有一瓶质量分数为19.6%的稀硫酸,请回答:
(1)配置200g这种溶液需 g溶质质量分数为98%的硫酸。
(2)现取10g配置好的稀硫酸,向其中滴加溶质质量分数为10%的氢氧化钠溶液,恰好完全反应后,需要溶质质量分数为10%的氢氧化钠溶液质量是多少?
冶炼2000t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石多少吨?
已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4 Fe3O4+4CO↑+2CO2↑.
Fe3O4+4CO↑+2CO2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).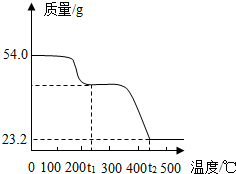
某干燥剂含氧化钙的质量分数是80%(杂质不吸水),理论上14g干燥剂能吸收水的质量是多少?有关反应的化学方程式为CaO+H2O═Ca(OH)2.
为减少二氧化碳等温室气体的排放,科学家采取“组合转化”技术,将CO2和H2在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和H2O,反应化学方程式为2CO2+6H2 C2H4+4H2O.若要制得28g C2H4,需要CO2的质量是多少?
C2H4+4H2O.若要制得28g C2H4,需要CO2的质量是多少?