阅读下面科普短文(原文作者:段翰英等)。
我国制作泡菜的历史悠久。制作泡菜是把新鲜蔬菜泡在低浓度的盐水里,经发酵而成。泡菜品种繁多、风味独特、口感鲜脆。
蔬菜中含有硝酸盐。硝酸盐对人体无直接危害,但转化成亚硝酸盐后,就会产生危害。亚硝酸盐[如亚硝酸钠(
)]与胃酸(主要成分是盐酸)反应,产生亚硝酸(
)和氯化物(如
)。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。
泡菜中含亚硝酸盐吗?含量有多少?含量受什么因素影响呢?
经实验测定发现,食盐水浓度和泡制时间对泡菜中亚硝酸盐含量有一定影响。下图为室温下,食盐水浓度和泡制时间与芹菜泡制过程中亚硝酸盐含量的关系。

用不同的蔬菜进行测定,变化趋势与芹菜相似。
实验表明,发酵温度对泡菜中亚硝酸盐的生成量及生成时间也具有明显的影响。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现的早,且数值低。这与温度较高有利于乳酸菌的繁殖有关。
实验还表明,泡制过程中添加姜汁和维生素
,都能有效地减少亚硝酸盐的生成。
现代医学证明,泡菜中的乳酸和乳酸菌对人体健康有益,具有抑制肠道中的腐败菌生长、降低胆固醇等保健作用。但是,有些泡菜盐分或糖分过高,对高血压和糖尿病等慢性病患者不利。另外,泡制过程也会造成某些营养素的流失。(有删改)
依据文章内容,回答下列问题。
(1)泡菜中的亚硝酸盐是由
(2)亚硝酸钠能与盐酸反应,该反应属于基本反应类型中的
(3)室温下,用芹菜制作的泡菜,最佳食用时间是
A.泡制2-3天 B.泡制5-6天 C.泡制12天后
(4)下列关于制作泡菜的说法中,合理的是
A.最好加入一些姜汁
B.最好在较低温度下泡制
C.最好加入一些富含维生素
的水果
D.最佳食用期的泡菜中亚硝酸盐的含量与泡制时的食盐水浓度无关
(5)请你为喜欢吃泡菜的人提一条食用泡菜的建议:
(10镇江27).有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中▲SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用是▲来检验。实验证明乙同学的观点不正确
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:
O2+4KI+4HCl=2I2+4KCl+2H2O,I2为碘单质。于是他设计了如下的实验装置:
(三)实验现象与结论:A中观察到▲,证明无O2;
B中观察到▲,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先▲以确保安全。
(5)由上述实验可知,硫酸铜溶液显▲性(填“酸”或“碱”)。
小明在购买氢气球时,看到摊主正在把废旧铝锅碎片投入盛有某种液体的铁制容器中,盖上容器盖子后,氢气就从导管口出来。
小明根据初中学过的科学知识,认为铁制容器中的液体肯定不是稀硫酸或盐酸。这种液体到底是什么?第二天小明请教老师,老师没有直接告诉答案,而是在实验室配制了一种液体后,对小明说:铁制容器中装的就是这种液体,它是一种常见化合物的溶液。还提供了相关信息,请小明自己动手探究。
提供的信息:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。如:钾——紫色;钠——黄色;钡——黄绿色;钙——砖红色。
下表是小明的实验步骤和现象记录:
| 序号 |
实验步骤 |
实验现象 |
| ① |
观察溶液 |
无色液体 |
| ② |
取少量该溶液于试管中,滴加紫色石蕊试液 |
紫色石蕊试液变蓝色 |
| ③ |
另取少量溶液在酒精灯火焰上灼烧 |
火焰呈现黄色 |
| ④ |
取少量该溶液于试管中,先滴加硫酸铜溶液,再滴加稀盐酸 |
先有蓝色沉淀生成,加入稀盐酸后沉淀消失,无其它明显现象 |
回顾与解释:
(1)小明认为铁制容器中的液体肯定不是稀硫酸或盐酸。理由是。
(2)在步骤④中,小明加入稀盐酸的目的是防止的干扰(填写离子符号)。
(3)小明通过实验,可得出该溶液中的溶质是。
(4)小明想进一步了解铝和这种溶液反应的原理,再次请教科学老师,老师启发小明说:铝和这种溶质以及水发生反应,生成含有偏铝酸根离子(AlO2-)的盐和氢气两种物质。请你尝试写出该反应的化学方程式:。
(10芜湖15).某化学小组的同学将一枚洁净的铁钉放入食盐水中(如图,装置气密性良好)。一段时间后,进行观察。请你一起参与分析,并完成后续实验设计。
〔观察现象〕①装置中右侧导管的液面升高。
②铁钉生锈,试管底部有黑色固体物质。
〔提出问题〕导管中液面为何升高?黑色固体物质又是什么?
〔理论分析〕小组同学根据已学习过的知识分析得知,液面上升的原因是
。
〔猜想与假设〕小组中的小明同学猜测该黑色固体可能含有:①Fe、②Fe3O4、③FeCl3、
④C四种物质
〔分析与验证〕小组同学根据小明的四种猜测做了以下分析:
(1)小红同学认为不可能含有氯化铁,该结论也得到小组同学的认可,理由是。
(2)小强同学认为一定含有碳,该结论也得到了小组同学的认可,理由是。
(3)小组同学不能确定是否含有铁,请你帮他们设计方案进行确认:
| 实验步骤 |
实验现象 |
实验结论 |
| 你选用的试剂是: |
〔知识链接〕相信你一定在家中做过铁钉分别在水以及食盐水中生锈的实验,你的结论之一是铁钉在(填“水”或“食盐水”)中生锈快。
(10滨州25).在学校的元旦联欢会上,某同学表演了“水能生火”的魔术。他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小明很兴趣,于是,他和同学们进行探究。
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另一种物质生成;
②反应过程中可能有热量放出
[设计装置]如右图所示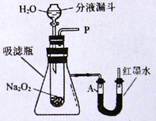
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)小利猜想生成的气体可能是氢气,也可能是氧气。小利猜想的依据是。
(2)小宁打开装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是。
(3)实验过程中,还观察到U型管A端红墨水液面下降,其原因是。
实验二:继续探究反应后生成的另一种是什么?
(1)小明取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈性。
(2)小军认为,纯碱溶液也能使酚酞试液变红色,所以另一种物质有可能是Na2CO3,小宁认为不可能,他可选用试剂来验证另一种物质是否是Na2CO3;
(3)小明在转移实验一所得溶液时,不小心手上沾有部分该溶液,小明应该如何处理:。
[表达]由实验探究的结果,写出过氧化钠和水反应的化学方程式:。
小明在学习了空气的相关知识后,对自家地下车库里的空气产生了兴趣,想要探究一下其中的氧气含量与课本上的数据是否一致。
(1)小明可以找到的器具有:瓶子、注射器、塑料袋、细绳、玻璃片、气球、小刀等。请你选取其中合适的工具帮他设计两种取样方案。
方案1:
方案2:
(2)假设你已经帮助小明取回了一集气瓶的空气样品,现需将其转移到集气瓶B中储存起来以备测定。现有如下装置,请你帮他设计一个转移气体的方案。