现代传感信息技术在化学实验中有广泛的应用。

Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。

(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
有机物A的结构简式为 ,它可通过不同的化学反应分别制得B、C、D和E四种物质。
,它可通过不同的化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是(填代号)。
(2)写出由A生成B的化学方程式和反应类型
,反应类型:。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(4)C能形成高聚物,该高聚物的结构简式为。
(5)写出D与NaOH溶液共热反应的化学方程式。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式:。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ图Ⅱ
根据上图分析:工业生产中最佳温度为℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为。
(1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: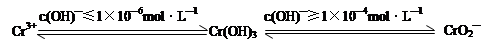
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-=+2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量ƒ随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。
从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙:
(1)两个方案中,符合当前生产中绿色化学理念的是方案,理由是方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________ _ ______。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+=Fe 3+ + Ce3+
计算上述样品中CuCl的质量分数为。
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: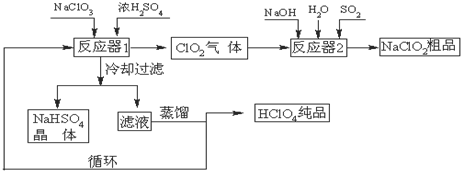
(1)冷却过滤的目的是降低NaHSO4的,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为,SO2的
作用是作剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较(填“高”或“低”),容易从溶液中逸出,循环使用的物质是。