常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是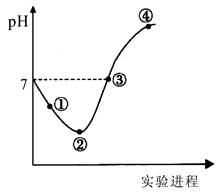
| A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH |
| B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- |
| C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-) |
| D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-) |
下列叙述错误的是
| A.可用铝制容器盛装稀硫酸 |
| B.Na2O2可用于呼吸面具中作为氧气的来源 |
| C.Fe2O3常用于制造红色油漆和涂料 |
| D.Si可用于制造太阳能电池 |
下列有关化学能与热能的说法正确的是
| A.铝热反应属于吸热反应 |
| B.若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 |
| C.吸热反应是指需要加热才能进行的反应 |
| D.H2与Cl2的反应过程中,分子转化为原子是吸收能量,原子转化为分子是放出能量 |
下列离子方程式中,正确的是
| A.钠和水反应:Na+2H2O = Na++2OH-+H2↑ |
| B.铜跟稀硝酸反应:3Cu+ 8H++2NO3-=3Cu2++2NO↑+4H2O |
| C.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O |
| D.向AlCl3溶液中加入过量的氨水溶液:Al3+ + 3OH-= Al(OH)3↓ |
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.升高温度可以增大反应速率 |
| C.增大N2浓度可以使H2转化率达到100℅ |
| D.增大N2浓度可以增大反应速率 |
下列实验中,始终无明显现象的是
| A.NH3通入AlCl3溶液中 |
| B.SO2通入HNO3酸化的Ba(NO3)2溶液中 |
| C.NO2通入FeSO4溶液中 |
| D.CO2通入CaCl2溶液中 |