X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z为地壳中含量最多的金属元素,下列说法中正确的是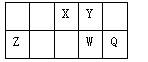
| A.X、Y、W三种元素最低价氢化物的沸点依次升高 |
| B.原子半径:Q>W>Z>Y>X |
| C.最高价氧化物对应水化物的酸性:Q>W>Z |
| D.X及Q的气态氢化物相反应,形成的化合物为离子化合物 |
按能量由低到高的顺序排列,正确的一组是()
| A.1s、2p、3d、4s | B.1s、2s、3s、2p | C.2s、2p、3s、3p | D.4p、3d、4s、3p |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为()
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
下列分子或离子中,含有孤对电子的是()
| A.H2O | B.CH4 | C.SiH4 | D.NH4+ |
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是()
| A.该元素单质是导体 | B.该元素单质在一定条件下能与盐酸反应 |
| C.该元素的氧化物的水合物显碱性 | D.该元素的最高化合价呈+5价 |
x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知()
| A.x的原子半径大于y的原子半径 |
| B.x的电负性大于y的电负性 |
| C.x阴离子的半径小于y阳离子的半径 |
| D.x的第一电离能小于y 的第一电离能 |