化学实验装置的科学设计是实验是否取得预期效果的关键。某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式 。甲同学的实验应该在_____ 中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
(3)请用平衡移动原理解释B装置的作用 (结合方程式与文字表述)。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的离子方程式 。
某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答: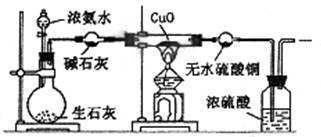
⑴实验前先将仪器按图连接好,然后,再开始实验。
⑵实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成色,
盛无水CuSO4的干燥管内出现色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中的反应方程式为(2分),这个反应说明氨气具有性。
⑶洗气瓶中浓硫酸的主要作用是。
⑷在最后出气管口收集干燥、纯净的氮气,收集方法是(填编号)
| A.向上排空气法 | B.向下排空气法 | C.排水法 | D.用塑料袋或球胆收集 |
(12分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
| 实验步骤 |
有关问题 |
| (1)计算所需KCl的质量 |
需要KCl的质量为______g |
| (2)称量KCl固体 |
称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 |
为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 |
为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 |
在进行此操作时应注意的问题是__________________________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
______________________________________________________
某同学应用如下所示装置研究物质的性质。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:

(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是____________________。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理_________________________________________
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
①生成的黑色(单质)物质是(填化学式)。
②这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为
③根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
④将实验②产生的刺激性气味气体通入氯水中,可以看到氯水_________ ,说明这种气体具有_____________________性;请写出该反应的化学方程式
(12分) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液 与用不含O2的蒸馏水配制的NaOH溶液反应制备。
与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入。(2)除去蒸馏水中溶解的O2常采用的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是。
(4)检验Fe3+存在的最佳试剂是,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式 。
。