常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.含大量Fe3+的溶液中:Na+、Mg2+、SO42—、SCN— |
B. =106的溶液中:NH4+、K+、AlO2—、NO3— =106的溶液中:NH4+、K+、AlO2—、NO3— |
| C.能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42—、Cl— |
| D.1.0 mol·L—1的KNO3溶液中:Fe2+、H+、Cl—、I— |
下列措施不能达到节能减排目的的是( )
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g)的化学反应(反应放热),下列叙述一定正确的是( )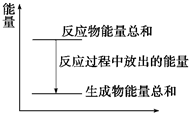
| A.反应过程中的能量关系可用上图表示 |
| B.1 mol锌的能量高于1 mol H2所含的能量 |
| C.若将该反应设计成原电池,锌为负极 |
| D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:
若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |