常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是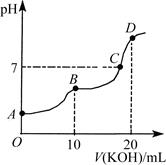
| A.KHC2O4溶液呈弱碱性 |
| B.B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-) |
| C.C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4) |
| D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
下列各式中,属于正确的电离方程式的是
A.HC03-+H20 H2C03+OH- H2C03+OH- |
B.HC03- +OH-=H20+C032- |
C.NaHC03 Na++HC03- Na++HC03- |
D.NH3·H2O NH4++OH- NH4++OH- |
下列对化学反应的认识正确的是
| A.化学反应过程中,分子的种类和数目一定发生改变 |
| B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| C.化学反应过程中,一定有化学键的断裂和形成 |
| D.放热反应的反应速率一定比吸热反应的反应速率大 |
“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应
| A.CO和CH3OH | B.CO2和H2O | C.H2和CO | D.CH3OH和H2 |
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元——苯并呋喃(Z),W是中间产物(R1、R2均为烃基)。则下列有关叙述正确的是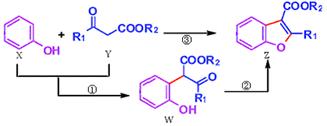
| A.反应①属于加成反应 |
| B.X分子式为C6H6O |
| C.X、Y、W、Z都能与NaOH溶液反应 |
| D.可用溴水或FeCl3溶液鉴别X和W |
能正确表示下列反应的离子方程式是
| A.乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH- → CH3COOH+ C2H5O- |
| B.用银氨溶液检验乙醛的醛基: CH3CHO +2Ag(NH3)2+ + 2OH-  CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O |
C.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.甘氨酸与氢氧化钠溶液反应: |