实验室用含有杂质(FeO、 Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 Ph=5时沉淀完全)。其中分析错误的是
| A.步骤②发生的主要反应为:2Fe2+ +H2O2 +2H+ = 2Fe3+ + 2H2O |
| B.步骤②可用氯水、硝酸等强氧化剂代替 H2O2 |
| C.步骤③用 CuCO3代替CuO也可调节溶液的pH |
| D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2 ~ 3次 |
下列说法正确的是
| A.利用高纯度二氧化硅制造的太阳能电池板可将光能直接转化为电能 |
| B.硝化甘油、火棉、TNT均是硝酸酯化反应以后的产物 |
| C.煤中加入生石灰、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料都能有效减少环境污染 |
| D.红外光谱法、紫外光谱法、核磁共振、同位素示踪法等都是现代化学测定有机物结构的常用方法 |
从下列实验事实所得出的结论,正确的是
| 实验事实 |
结论 |
|
| ① |
Cl2的水溶液可以导电 |
 是电解质 是电解质 |
| ② |
常温下,0.1mol/LNaA与NaB溶液的pH前者大 |
酸性:HA<HB |
| ③ |
常温下,白磷可自燃而硫不与氧气反应 |
非金属性:P>S |
| ④ |
某溶液中滴加KSCN溶液,溶液变为血红色 |
该溶液含有Fe3+ |
A.③④ B.②④ C.①② D.全部
下列各选项所描述的两个量中,前者一定大于后者的是
| A.pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B.pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C.0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率 |
| D.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
下表所列各组第I栏中的化学反应与第II栏中的化学反应都可以用第III栏中的离子方程式表示的是
| 选项 |
第I栏 |
第II栏 |
第III栏 |
| A |
往少量NaOH溶液中投入铝片 |
往过量NaOH溶液中投入铝片 |
Al+2OH-+2H2O===2AlO2-+3H2↑ |
| B |
往Fe2(SO4)3溶液中滴入氢氧化钠溶液 |
往Fe2(SO4)3溶液中滴入氢氧化钡溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
NaHCO3溶液滴入Ca(OH)2溶液 |
NaHCO3溶液滴入NaOH溶液 |
OH-+HCO3-===CO32-+H2O |
| D |
往NaOH溶液中通入过量CO2气体 |
往NaOH溶液中通入少量CO2气体 |
CO2+OH-="==" HCO3- |
常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是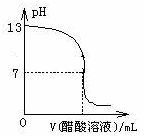
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.继续滴加0.1mol·L-1醋酸溶液,溶液pH可以变为1 |