[化学 ― 选修 3 :物质结构与性质] 化学中的某些元素与生命活动密不可分。请回答下列问题:
(1)(NH4)2SO4是一种重要的化学肥料,其中N、S原子的杂化方式分别是 、 ,SO2-4的空间构型为 。
(2)钙是儿童生长不可缺少的元素,基态钙原子中,电子没有全充满的能层是 。
(3)蛋白质中含有N、P等元素,它们分别形成的简单气态氢化物键角大小关系是 (用化学式表示),原因是 。
(4)金属铁、镍及其形成的许多化合物常用作催化剂。已知NiO、FeO的晶体类型均与氯化钠晶体相同,熔点NiO>FeO,推测 Ni2+和 Fe2+离子半径的大小关系是 ,作出判断的依据是 。
(5)某金属是抗癌药物中的明星元素,其晶体中原子的堆积方式如图所示。
晶胞中金属原子的配位数为 。若已知金属的摩尔质量为M g/mol ,阿伏加德罗常数为NA,原子半径为r pm,则该晶胞的密度为 p= g/ cm3。(用含M、NA、r的计算式表示,不用化简)
由乙烯和其他无机原料可合成环状化合物,其合成过程如下图所示(水及其他无机产物均已省略):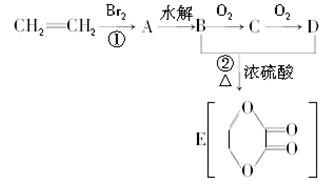
请分析后回答下列问题:
(1)反应的类型分别是①________,②________;
(2)D物质中的官能团为________;
(3)C物质的结构简式为________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_______________.
某元素的原子获得能量后的电子排布式为1s22s22p63s23p34s1,则该元素
的原子获得能量前的电子排布式为 ___________;元素符号为
_______;其最高价氧化物对应的水化物的化学式是________。
水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知H3O+ + OH- = 2H2O,H3O+的立体构型是_________,中心原子的杂化类型是_______。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是
A、极性键 B、非极性键 C、配位键
(3)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是
A、金刚石 B、干冰 C、食盐 D、固态氨
砷原子的最外层电子排布式是4s24p3,砷元素在周期表中的位置;其最高价氧化物的化学式为,砷酸钠的化学式是。
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水大的是________.
(2)一瓶无色气体,可能含有CH4和CH2=CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
②上述实验中可能涉及的反应类型有___________