下列评价及离子方程式书写正确的是
| 选项 |
离子组 |
评价 |
| A |
H+、Fe2+、NO3—、Cl— |
不能大量共存于同一溶液中,因为发生了氧化还原反应 4Fe2++NO3—+6H+=4Fe3++2NO↑+3H2O |
| B |
Na+、CO32—、Cl—、Al3+ |
不能大量共存于同一溶液中,因为发生了互促水解反应 2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑ |
| C |
Fe3+、K+、SCN—、Br— |
不能大量共存于同一溶液中,因为有红色沉淀生成 Fe3++3SCN—===Fe(SCN)3↓ |
| D |
HCO3—、OH—、Na+、Ca2+ |
不能大量共存于同一溶液中,因为发生如下反应 HCO3—+OH—===CO2↑+H2O |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
| A.1 : 1 | B.2 : 1 | C.1 : 10 | D.10 : 1 |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是
| A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定时,没有逐出滴定管下口的气泡 |
| D.读数时,视线与滴定管内液体的凹液面最低处保持水平 |
分析下面的能量变化示意图,下列热化学方程式正确的是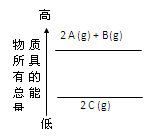
| A.2A(g)+ B(g)=2C(g);△H=a(a>0) | B.2A(g)+ B(g)=2C(g);△H=a(a<0) |
| C.2A + B="2" C;△H=a(a<0) | D.2C="2A" +B;△H=a(a>0) |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol·L-1与Bmol·L-1,则A和B的关系为
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |