下列措施不能达到节能减排目的的是()
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替 |
下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③用酒精萃取碘水中的碘
④蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
⑤取用放在细口瓶的液体时取下瓶塞倒立放在桌面上,倾倒液体时瓶上的标签向地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
| A.①④⑦⑩ | B.①④⑤⑦⑩ | C.①④⑤⑦⑧⑩ | D.④⑤⑦⑧⑩ |
水的相对分子质量为18,则一个水分子的质量为(设NA为阿伏加德罗常数)
A. g g |
B.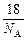 g/mol g/mol |
C.18NA g | D. |
用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A.干燥的 | B.瓶塞不漏水的 |
| C.用欲配制的溶液润洗过的 | D.以上三项均须要求的 |
现有HCl、H2O、NH3三种物质,它们分别都含有1mol氢原子,则三种物质的物质的量之比为( )
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.6∶3∶2 |