相同温度下,在体积相等的三个密闭容器甲、乙、丙中发生可逆反应:N2(g)+ 3H2(g)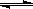 2NH3(g) △H=-92.4 kJ/mol。其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.4 kJ/mol。其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表: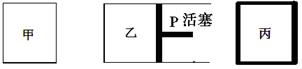
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
1 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.N2的转化率:丙是甲的二倍
B.三个容器内反应的平衡常数:甲=乙>丙
C.达平衡时氨气的体积分数:甲>乙>丙
D.放出热量关系: b < a < 92.4
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是( )
| A.原子半径:④>③>②>① | B.第一电离能:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
下列是几种原子的基态电子排布,电负性最大的原子是( )
| A.1s22s22p63s23p64s2 | B.1s22s22p63s23p3 |
| C.1s22s22p63s23p2 | D.1s22s22p4 |
下列表达式错误的是( )
A.甲烷的电子式: 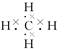 |
B.氮原子的L层电子排布图: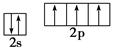 |
| C.硫离子的核外电子排布式:1s22s22p63s23p4 |
| D.碳12原子: 612C |
在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间构型为( )
| A.十二面体 | B.正六面体 | C.正八面体 | D.正四面体 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液中加入乙醇,溶液没有发生变化 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |