欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。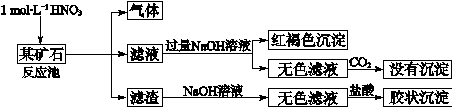
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的: ;若按以上方案:NO与O2循环通入反应池处理该矿石2.36103 kg,得到滤渣1.2103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是
| A.蒸馏 | B.分液 | C.过滤 | D.蒸发 |
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后
| A.整个溶液变紫色 | B.整个溶液变为棕黄色 |
| C.上层几乎无色,下层为紫红色 | D.下层无色,上层紫红色 |
检验某未知溶液中是否含有SO42-,下列操作最合理的是
| A.加入稀硝酸酸化的Ba(NO3)2溶液 |
| B.加入盐酸酸化的BaCl2溶液 |
| C.先加稀硝酸酸化,再加Ba(NO3)2溶液 |
| D.先加盐酸酸化,再加BaCl2溶液 |
对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是



A. B.C. D.
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比是
| A.1:1 | B.2:1 | C.3:2 | D.4:1 |