(12分)据图回答下列问题:
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是___________,负极反应式为:_________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为__ ___。
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
(1)该电池工作时,b通入的物质为_____ __,c通入的物质为___ ___。
(2)该电池负极的电极反应式为:_______
(3)工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有______________NA个电子转移。
以合成氨工厂工艺流程如下图,试回答相关问题: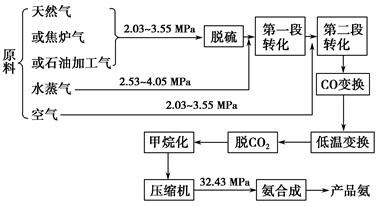
(1)不同的原料生产氢气其经济指标如下表:
| 天然气 |
石脑油 |
重油 |
煤焦 |
|
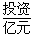 |
5.6 |
6.5 |
8.0 |
- |
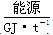 |
28~30 |
35.5 |
41.8 |
54.4 |
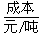 |
257 |
390~447 |
220~280 |
500 |
从上表数据及自然资源来看最具发展前景的是________。
A.天然气B.石脑油C.重油 D.煤焦
(2)脱硫工艺一般是通过金属氧化物来实现的,通过三步反应最后再生成金属氧化物,并得到单质硫,请补充第三步反应。
①MezOy+zH2S+(y-z)H2=MezSz+yH2O
②MezSz+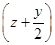 O2=MezOy+zSO2
O2=MezOy+zSO2
③__________________________________________________
(3)气体的精制 经净化过的气体仍有少量的CO等有害气体。常用的方法有铜洗法和甲烷化法。CO(g)+Cu(NH3)2Ac+NH3(l)[Cu(NH3)3CO]Ac;正反应放热,反应在铜洗塔中进行,吸收后的铜液送到再生器中,在再生器处解吸CO,适宜条件是________,解吸后铜液循环使用。甲烷化法则是把CO、CO2转化为对氨合成无害的CH4,主要反应是CO(g)+3H2(g) CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。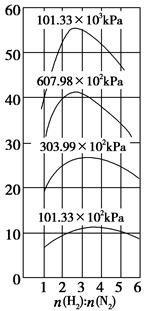
(4)500 ℃时,y随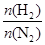 及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的
及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的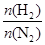 是________。
是________。
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ |
用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有________(填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D.通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是____________(用离子方程式表示)。
(2)方法Ⅱ中主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=8.0 kJ·mol-1
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=90.4 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为________。
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如下图所示。阳极区放出气体的成分为________(填化学式)。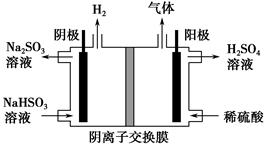
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: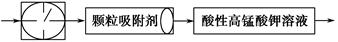
①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);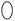 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。