蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O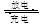 Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
| B.充电时阴极的电极反应式为:Fe(OH)2 +2e-=Fe+2OH- |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
室温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B.甲基橙呈红色的溶液 NH4+、Ba2+、AlO2-、Cl- |
| C.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br- |
| D.与铝反应产生大量氢气的溶液 Na+、K+、CO32-、NO3- |
化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是()
A.纯碱溶液呈碱性的原因可表示为:CO32-+ 2H2O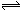 H2CO3 + 2OH- H2CO3 + 2OH- |
B.氯的原子结构示意图为: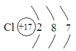 |
| C.草酸使酸性KMnO4溶液褪色,其离子方程式为: 5C2O4 2-+ 2MnO4-+ 4H2O= 2Mn2+ + 10CO2↑ + 8OH—; |
D.氯分子的电子式: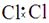 |
下列离子方程式正确的是()
| A.向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—; |
| B.铁的吸氧腐蚀正极电极反应:O2+4e—+ 2H2O = 4OH— |
| C.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4—+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是()
①澄清石灰水中通过量的CO2;②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水; ④向硅酸钠溶液中逐滴加入过量的盐酸
| A.②④ | B.①③ | C.③④ | D.④ |
根据右图,可判断出下列离子方程式中错误的是()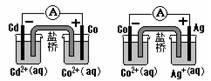
| A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) |
| B.Cd (s)+Co2+(aq)=Cd2+(aq)+Co(s) |
| C.2Ag+ (aq)+Cd(s)=2Ag(s)+Cd(aq) |
| D.2Ag+ (aq)+Co(s)=2Ag(s)+Co(aq) |