利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是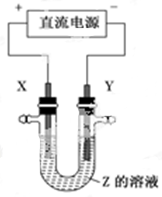
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
14.已知:2H2(g) +O2(g) =2H2O( l ) kJ·mol-1
kJ·mol-1
CH4(g) +2O2(g) =CO2(g) +2H2O( l ) kJ·mol-1
kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O( l ),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是
| A.1:1 | B.1:3 | C.1:4 | D.2:3 |
13.下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热 kJ/mol,则H2SO4和Ca(OH)2反应的中热 kJ/mol,则H2SO4和Ca(OH)2反应的中热 kJ/mol kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的 kJ/mol kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
12.“熵”可看作是“混乱度”,它的符号是“S”。下列变化中,△S<0(“混乱度”减小)的是
| A.3Fe(s)+4H2O(g) =Fe3O4(s)+4H2(g) |
| B.2NO2(g) =N2O4(l) |
| C.2IBr(l) =I2(s)+Br2(g) |
| D.(NH4)2CO3(s) =2NH3(g)+CO2(g)+2H2O(g) |
11.100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的
| A.碳酸钠(固体) | B.水 |
| C.硫酸钾溶液 | D.CH3COONa(固体) |
10.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中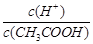 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |