选做(12分)【化学——物质结构与性质】第二周期中碳、氮、氧是构成生命物质的三种主要元素,其单质及化合物在生产生活中也有着重要的应用。
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在痕量(C2H5O)P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是________。CH3COOH的沸点比HCOOCH3高的主要原因是_______________________。
(4)CH2=CHCN是制备晴纶的原料,其分子中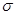 键和
键和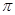 键的个数之比为______(填最简整数比)。
键的个数之比为______(填最简整数比)。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。每个碳原子周围与其距离最近的硅原子有________个。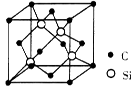
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
分某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了一系列实验,实验结果记录如下: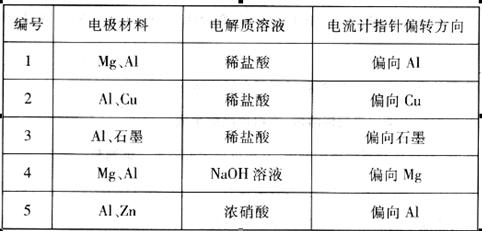
请根据上表中的实验记录回答下列问题:
(1)实验1、2中的Al所作的电极是否相同?____________________。
(2)在实验3中,Al作__________极,电极反应式为___________,电池总反应式为__________。
(3)实验4中的Al作正极还是负极?____________________,原因是____________________。
(4)解释实验5中电流计指针偏向Al的原因:__________________。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到哪些因素的影响?____________________。
分在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。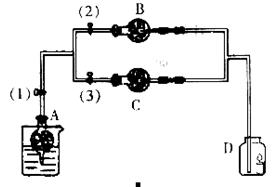
(1)装置B的淡黄色粉末是____________,干燥管C中的白色固体应为_____________,
(2)A中发生反应的离子方程式为____________,
(3)B中发生的化学反应方程式为____________。
分实验室用碳酸钠晶体配制1.00 mol/L的溶液l00mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、量筒________、________和胶头滴管;
(2)本实验须称量碳酸钠晶体(Na2CO3.10H2O)________g。
(3)容量瓶上标有:____________、____________、____________。
(4)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后直接倒进所选的且经检查不漏水的容量瓶中,洗涤烧杯2—3次,洗涤液也移至容量瓶中,晃动容量瓶使其混合均匀,然后加水至离刻度线2cm处,用胶头滴管加水至刻度线,倒入试剂瓶贴上标签备用。请指出上述操作中的两处明显错误:______________________;
分人民网西昌报道组2013年10月1日电:约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。
已知:A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b=c-l;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。请解答下列问题:
(1)A元素在元素周期表第________族中,D元素在元素周期表第________周期中。
(2)B原子的原子结构示意图为________。
(3)A、B两种元素形成的四原子分子的电子式为________。
(4)A的单质与C的单质发生反应的化学方程式为________。