Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过一系列操作,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后余氯含量的方案如下:在250ml碘量瓶(或具塞锥形瓶)中放置0.5gKI,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以Cmol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)上述实验,消耗标准Na2S2O3溶液V mL,则自来水样品中余氯量(以游离Cl2计算)为 mg·L-1。实验中,若“塞上塞摇动”动作缓慢,则测得结果 (填“偏高”“偏低”或“不变”)。
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以
,
和金属离子的配离子
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和
,在
<2的条件下加热蒸馏,蒸出所有的
,并用
溶液吸收。
②滴定:将吸收液调节至
>11,以试银灵作指示剂,用
标准溶液滴定
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
(1)水样预处理的目的是。
(2)水样预处理的装置如右图,细导管插入吸收液中是为了。
(3)蒸馏瓶比吸收液面要高出很多,其目的是。
(4)如果用盐酸代替磷酸进行预处理,实验结果将(填"偏高"、"无影响"或"偏低")。
(5)准确移取某工厂污水100
,经处理后用浓度为0.01000
的硝酸银标准溶液滴定,终点时消耗了21.00
。此水样中含氰化合物的含量为
(以
计,计算结果保留一位小数)。
为测定一种气态烃A的分子式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO、水蒸气。学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除),试完成下列问题: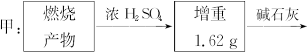
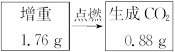

(1)两种方案能否都可求出A的实验式(即C、H原子个数比)?
(2)若能求,通过计算求出A的实验式。
(3)若要确定A的分子式,是否还需要测定其他数据?如果需要,该测定哪些数据?
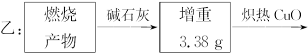
如下图,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体点燃,把燃烧后生成的气体通过A、B两个洗气瓶。试完成下列问题: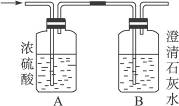
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是___________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是___________。
(3)若A和B两个洗气瓶的质量都增加,则气体X可能是______________________。
下图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷盘内的烃样品经加热分解或气化后用纯O2气流驱赶经过灼热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。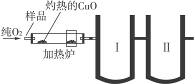
已知下列数据:
| 瓷盘 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
| 瓷舟 |
样品+瓷舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
| A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
(1)烃样品在反应过程中所用的氧化剂是________________________。
(2)吸收管Ⅰ应装的吸收剂是________,吸收管Ⅱ应装的吸收剂是________。
(3)样品中碳的质量分数的数学表达式是____________________。
(4)样品中氢的质量分数的数学表达式是____________________。
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: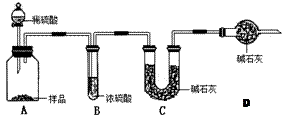
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl, 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用(填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是。
乙:准确称取10.00g样品后,用(填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 |
实验结果的评价 |
实验失败的主要原因及对结果的影响 |
| 甲 |
失败 |
||
| 乙 |
 成功 成功 |
||
| 丙 |
 成功 成功 |