下列操作不能达到目的的是
| 选项 |
目的 |
操作 |
| A |
配制100 mL 1.0 mol·L-1 CuSO4溶液 |
将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C |
在溶液中将MnO4-完全转化为Mn2+ |
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D |
确定NaCl溶液中是否混有NA2CO3 |
取少量溶液滴加CaCl2溶液,观察是否出现白色沉淀 |
阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味, 甜度约为蔗糖的200倍。下列关于阿斯巴甜的说法错误的是
| A.在一定条件下能发生取代反应、加成反应 |
| B.酸性条件下的水解产物中有两种氨基酸 |
| C.在一定条件下既能与酸反应、又能与碱反应 |
| D.分子式为C14H18N2O5,属于蛋白质 |
除去下列括号内杂质的试剂和方法错误的是
| A.HNO3溶液(H2SO4):适量BaCl2溶液,过滤 |
| B.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气 |
| C.KNO3晶体(NaCl):蒸馏水,重结晶 |
| D.C2H5OH(CH3COOH):加足量CaO,蒸馏 |
某高分子材料的结构如图所示: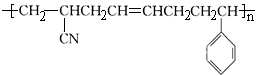
以下与此高分子材料相关的说法正确的是
| A.合成该高分子材料的反应是缩聚反应 |
| B.该高分子材料是由三种单体聚合而成的 |
| C.合成该高分子材料的部分单体不能使溴水和酸性高锰酸钾溶液褪色 |
| D.该高分子材料是体型结构高分子,具有热固性 |
下列文字表述与反应方程式对应正确的是
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+ Ag+ = AgBr↓ |
| B.用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
C.实验室用液溴和苯在催化剂作用下制溴苯: |
| D.硝酸银溶液中滴加过量氨水:Ag+ + NH3·H2O =" AgOH↓+" NH4+ |
苯酚分子结构中化学键如图所示,关于苯酚在各种反应中断键的说明不正确的是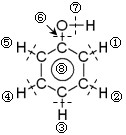
| A.和氢气发生加成时大π键⑧断裂 |
| B.和金属钠反应时键⑦断裂 |
| C.和饱和溴水反应时键①、③、⑤断裂 |
| D.制备酚醛树脂时键②、⑥断键 |