下列离子方程式书写正确的是
A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
B.腐蚀法制作印刷线路板:Fe3++Cu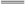 Fe2++Cu2+ Fe2++Cu2+ |
C.CA(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH- CaCO3↓+H2O CaCO3↓+H2O |
D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+ Al(OH)3+3H+ |
下列反应中属于氧化还原反应,且水作为氧化剂的是
| A.Cl2+H2O=HCl+HClO | B.2Na+2H2O=2NaOH+H2↑ |
| C.2F2+2H2O=4HF+O2 | D.2Na2O2+2H2O=4NaOH+O2↑ |
下列表格中各项分类都正确的一组是
| 类别 选项 |
纯净物 |
混合物 |
电解质 |
非电解质 |
|
下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥是的
A.C12 B .O2C.SO2 D.NH3
.O2C.SO2 D.NH3
当光束通 过下列分散系时,可能产生丁达尔效应的是
过下列分散系时,可能产生丁达尔效应的是
| A.NaCl溶液 | B.Fe(OH)3胶体 | C.盐酸 | D.蒸馏水 |
下列实验操作中错误的是
| A.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计的水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应用酒精灯将溶液蒸干 |
| D.称量时,应将砝码放在托盘天平的右盘上 |