将100 mL 1 mol/L的NaHCO3溶液等分成两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中C(CO32-)的变化分别是
| A.减小、减小 | B.减小、增大 | C.增大、增大 | D.增大、减小 |
在一密闭容器中充入1molNO2气体,建立如下平衡2NO2  N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
| A.a>b | B.b>a | C.a=b | D.无法比较 |
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
| A.分别升高温度,两种溶液的pH均减小 |
| B.相同温度下两种溶液的pH:Na2CO3> NaHCO3 |
| C.分别加少量NaOH,两液c(CO32-)均增大 |
| D.两液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-) |
关于下图所示的原电池,下列说法正确的是 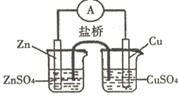
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H+ + 2e- = H2↑ |
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
在下列溶液中,各组离子一定能够大量共存的是
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |