(12分)金属铜及其化合物在生产和生活中都有重要的应用。
(1)写出铜原子价电子层的电子排布式______________。第四周期基态原子最外层电子数与铜相同的元素有_____________种。
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,然后向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀。
①SO42-中S原子的杂化方式为________________________。
②NH3分子内的H-N-H键角______(填“大于”“等于”或“小于”)H2O分子内的H-O-H键角。
(3)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为______________。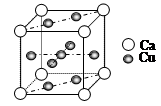
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构角度来说明CuO受热易分解的原因:__________________。
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应;电池工作时,极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式。
T ℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g) xC(g) ,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
xC(g) ,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为___,A的转化率为____.
(2)x=__________
(3)若继续向原平衡 状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
a.向正反应方向移动
b.向逆反应方向移动
c.不移动
(4)T ℃时,向2L密闭容器中充入4mo lC,反应达到平衡时,B的物质的量为______。
lC,反应达到平衡时,B的物质的量为______。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为___________________________,在X极附近观察到的现象是:__________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:____________________________________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,电极反应式是______,Y电极的材料是_________,电极反应式是_________。
(11分)按要求回答下列问题
(1)K HSO4溶液显 __性(填“酸” “碱” 或“中性”),其原因是(用电离方程式表示)
HSO4溶液显 __性(填“酸” “碱” 或“中性”),其原因是(用电离方程式表示) ;
;
(2) KHCO3溶液显 _性(填“酸” “碱” 或“中性”),其原因是(用离子方程式表示) ;
;
(3) 将上述两溶液混合,离子反应方程 式为。
式为。
(4)在Na2CO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是________________,其原因是(以离子方程式和简要文字说明) ___________________________________。
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):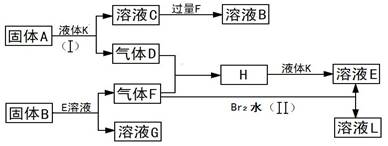
试回答:
(1)甲元素的名称为,溴元素在周期表的位置丁元素的阴离子结构示意图为。
(2)A的电子式为;所含化学键类型为。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)。
(4)反应(I)的化学方程式为。
(5)反应(II)的离子方程式为。