反应4NH3+5O2 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
| A.v(O2)=0.125mol·(L·s)-1 | B.v(NO)=0.01mol·(L·s)-1 |
| C.v(NH3)=0.01 mol·(L·s)-1 | D.v(NH3)=0.2 mol·(L·s)-1 |
下列实验装置或操作不符合实验要求的是
下列说法正确的是
A.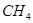 能使酸性 能使酸性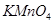 溶液褪色 溶液褪色 |
B.金属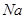 能置换 能置换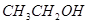 甲基中的氢生成 甲基中的氢生成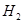 |
| C.乙酸有强烈的刺激性气味,其水溶液称为冰醋酸 |
D.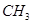 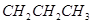 与 与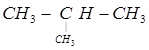 互为同分异构体 互为同分异构体 |
下列关于化学与生产、生活的认识不正确的是
| A.二氧化硫、二氧化氮和二氧化碳都是形成酸雨的物质 |
| B.用高锰酸钾溶液吸收水果产生的乙烯,能达到保鲜的目的 |
| C.金属锂是最轻的金属,且活动性强,是制造电池的理想物质 |
| D.含氮、磷的大量污水任意排放是造成水华、赤潮等水体污染的重要原因 |
下列说法不正确的是
| A.化学键是使离子或原子相结合的作用力 |
| B.气态单质分子中不一定存在化学键 |
| C.NaCl与NaOH固体中的化学键类型完全相同 |
| D.碳原子最外层有4个电子,能与其他原子形成4个共价键 |
“化学,让生活更美好”,下列叙述不能直接体现这一主题的是
| A.合成光纤,让通讯更快捷 | B.风力发电,让能源更清洁 |
| C.合成药物,让人类更健康 | D.环保涂料,让环境更宜居 |