如图所示是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是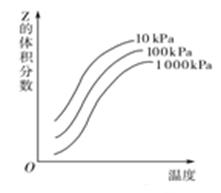
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种为气态、Z为气态 |
| D.上述反应的逆反应的ΔH>0 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) 2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
| A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 |
| B.若向容器中充入氦气,压强增大,Y的转化率提高 |
| C.升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D.开始充入容器中的X、Y物质的量之比为2∶1 |
已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
| A.向乙容器中充入一定量的氦气 | B.向乙容器中充入一定量的SO3气体 |
| C.升高乙容器的温度 | D.增大甲容器的压强 |
在密闭容器中进行下列反应:M(g)+N(g) C(g)+2L此反应符合下面图象,下列叙述正确的是
C(g)+2L此反应符合下面图象,下列叙述正确的是
A .正反应吸热,L是气体
.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 m
2C(g)达到平衡时,A、B和C的物质的量分别为4 m ol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
ol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol