工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ |
| C.反应至4 min时若HCl浓度为0.12 mol·L-1,则H2反应速率为0.03 mol·L-1·min-1 |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应 |
生活中每时每刻都发生着各种化学反应,下列反应不一定属于放热反应的是( )
| A.硫酸和氢氧化钡溶液的反应 | B.燃烧反应 |
| C.复分解反应 | D.中和反应 |
下列物质中都是既含有离子键又含有共价键的一组是( )
| A.NaOH, H2O, NH4Cl |
| B.KOH, Na2O2, (NH4)2S |
| C.MgO,CaBr2, NaCl |
| D.Na2SO4, HCl, MgCl2 |
锗(Ge)是第四周期第IVA族元素,处于元素周期表中金属区与非金属区的交界线处,下列叙述正确的是( )
| A.锗是一种金属性很强的元素 | B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性很强 | D.锗酸(H4GeO4)是难溶于水的强酸 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是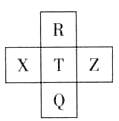
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
下列叙述中错误的是 ()
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |