镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiO(OH)+2H2O  Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是()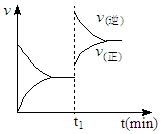
| A.2SO2(g)+O2(g) ⇌2SO3(g);ΔH<0 |
| B.4NH3(g)+5O2(g) ⇌4NO(g)+6H2O(g);ΔH<0 |
| C.H2(g)+I2(g) ⇌2HI(g); ΔH>0 |
| D.C(s)+H2O(g) ⇌CO(g)+H2(g);ΔH>0 |
在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是()
A.反应2SO2(g)+O2(g) 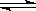 2SO3(g) 容器内的密度不随时间变化 2SO3(g) 容器内的密度不随时间变化 |
B.反应A2(g)+B2(g) 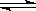 2AB(g)容器内的总压强不随时间变化 2AB(g)容器内的总压强不随时间变化 |
C.反应N2+3H2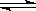 2NH3容器内气体平均相对分子质量不随时间变化 2NH3容器内气体平均相对分子质量不随时间变化 |
D.反应4A(s)+3B(g)  2C(g)+D(g)容器内气体平均相对分子质量不随时间变化 2C(g)+D(g)容器内气体平均相对分子质量不随时间变化 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)=2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1其中正确的是()
| A.①③ | B.①④ | C.②③ | D.③④ |
化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是()
2NH3的能量变化下图所示,该反应的热化学方程式是()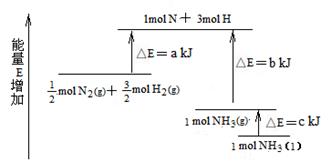
A.N2(g)+3H2(g)  2NH3(1);△H=2(a-b-c)kJ·mol-1 2NH3(1);△H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g);△H=-2(b-a)kJ·mol-1 2NH3(g);△H=-2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+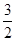 H2(g) H2(g)  NH3(1);△H=(b+c-a)kJ·mol-1 NH3(1);△H=(b+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+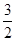 H2(g) H2(g)  NH3(g);△H=(a+b)kJ·mol-1 NH3(g);△H=(a+b)kJ·mol-1 |
下列说法或表示法正确的是()
| A.由“C(石)→C(金);△H=" +1.9" kJ/mol ”可知金刚石比石墨稳定 |
| B.在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H= -571.6kJ/mol |
| D.HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H= -(2×57.3)kJ/mol |