(8分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。
(1)B中的含氧官能团名称是。
(2)A→C的反应类型是;A~D中互为同分异构体的是。
(3)由A生成B的化学方程式是。
(4)C在一定条件下发生加聚反应的化学方程式是。
7.4 g有机物A完全燃烧生成8.96 L CO2(标准状况下)和9 g水,有机物B是A的同系物,1 mol B完全燃烧消耗氧气的物质的量比1 mol A完全燃烧消耗氧气的物质的量多1.5 mol,B能与Na反 应生成H2。
应生成H2。
(1)A的分子式为________,B的分子式为________。
(2)若A不能发生催化氧化反应,则A的结构简式为________,若B不能发生消去反 应,则B的结构简式为________________。
应,则B的结构简式为________________。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,则C至少有________个碳原子。
如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。 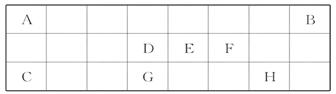
(1)上述元素的单质中熔点最高的可能是______(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是______ ____
____
的缘故。
(3)在一定条件下,A 与E可形
与E可形 成一种极易溶于水的气态化合物,其电子式为_______;该物质溶于水后的溶液呈_______性(填“酸”、“碱”或“中”)。
成一种极易溶于水的气态化合物,其电子式为_______;该物质溶于水后的溶液呈_______性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中_____族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_____ (填元素符号)元素组成的,用化学方程式表示吸收原理__________________________。
乙烯、苯是重要的化工原料,请写出下列化学方程式及反应类型。
(1)一定条件下,乙烯与水反应的化学方程式
反应类型为
(2)在适当的温度、压强和有催化剂存在的条件下,乙烯可形成高分子化合物聚乙烯,该反应方程式为,反应类型为
(3)向溴的苯溶液中加入适量的FeBr3_______________________,反应类型_________
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明是: 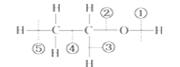
A.和金属钠反应时断裂键 B .在铜催化共热下与O2反应时断裂键
.在铜催化共热下与O2反应时断裂键
C.在消去反应时断裂键 D.在 酯化反应时断裂键