(6分)按下图装置实验,A、B两烧杯分别盛放200 g 10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极.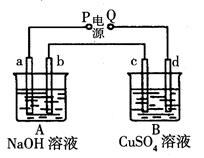
(1)标准状况下,b极产生气体的体积为__________L。
(2)c极上析出固体的质量为____________g。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:_________________________________________________________________________;由R生成Q的化学方程式为____________________________________________________________。
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是_________________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
E |
R |
F |
||||
| 3 |
A |
C |
D |
H |
I |
G |
|
| 4 |
B |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
已知A、B、C、D分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请回答下列问题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:_________________________________________________________________。
(2)若B、D属于同主族元素形成的单质分子,写出C的化学式:________。
(3)若A、B均是含有2个原子核的微粒,且B中含有10个电子,D中含有18个电子,则A、B之间发生反应的离子方程式为___________________________________________________。
(4)若D是一种含有22电子的分子,则符合如图所示转化关系的A为________________(写出物质的化学式,如果是有机物则写出相应的结构简式)。
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO42-、CO32-两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液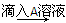 白色沉淀
白色沉淀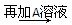 沉淀不溶解
沉淀不溶解
C溶液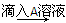 白色沉淀
白色沉淀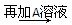 沉淀不溶解
沉淀不溶解
D溶液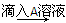 白色沉淀
白色沉淀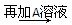 沉淀部分溶解
沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为_________________________________________________________________。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是_________________________________________________________________。
用离子方程式表示其原因:_________________________________________。